研究背景 甲状腺乳头状癌(PTC)是一种源于甲状腺滤泡上皮细胞的常见恶性肿瘤,因其生长缓慢且恶性程度相对较低而为大众所知。其中,PTMC特指直径小于10mm的PTC病灶,通常不易察觉且转移风险较小,但在体检筛查普及和技术进步的影响下,PTMC的确诊率逐年升高,新确诊的PTC患者中过半数属于PTMC。 自20世纪90年代起,日本Kuma医院和相关研究机构针对低危PTMC(T1aN0M0期)开展了主动监测研究,结果显示这类患者的肿瘤生长及淋巴结转移风险极低,在选择手术治疗的患者中,也没有出现致命复发或远处转移导致死亡的情况。因此,对于低风险PTMC,推荐采取主动监测而非过度治疗。然而,如何可靠、安全、准确地区分低/高风险PTMC病例,成为当前甲状腺外科医生关注的重要议题。 研究内容 该研究对393例PTC患者的BRAF, KRAS, NRAS,HRAS,TERT,TP53,PAX8/PPARG,CCDC6/RET和NCOA4/RET的NGS测序结果进行回顾性分析,结合临床病理特征探讨其是否可识别低危或高危PTMC患者。 中国甲状腺肿瘤学会(CATO)建议,低风险PTMC的肿瘤直径不应超过5mm。本研究中393例PTC肿瘤直径小于等于15mm,术后随访时间为6至103个月,中位随访时间为20个月。我们根据肿瘤大小将这些患者分为三组(见图1)。测量范围为10mm至15mm的肿瘤,被认为代表视觉上可见的PTMC的临床进展。 图1 纳入研究的PTC患者示意图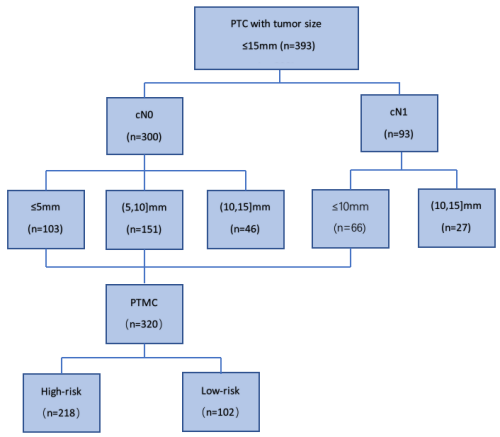
研究结果
研究结果显示与cN0 PTC相比,cN1 PTC表现出更具侵袭性的特征,如肿瘤直径更大、双侧性、多灶性、甲状腺内扩散以及甲状腺腺体外侵犯。然而,在cN0和cN1组间未观察到BRAFV600E、NRASQ61R、KRASQ61K、TERTC228T/C250T和RET/PTC的分子变异具有显著差异(见表1)。
表1:cN0组和cN1组PTC的临床病理及分子变异特征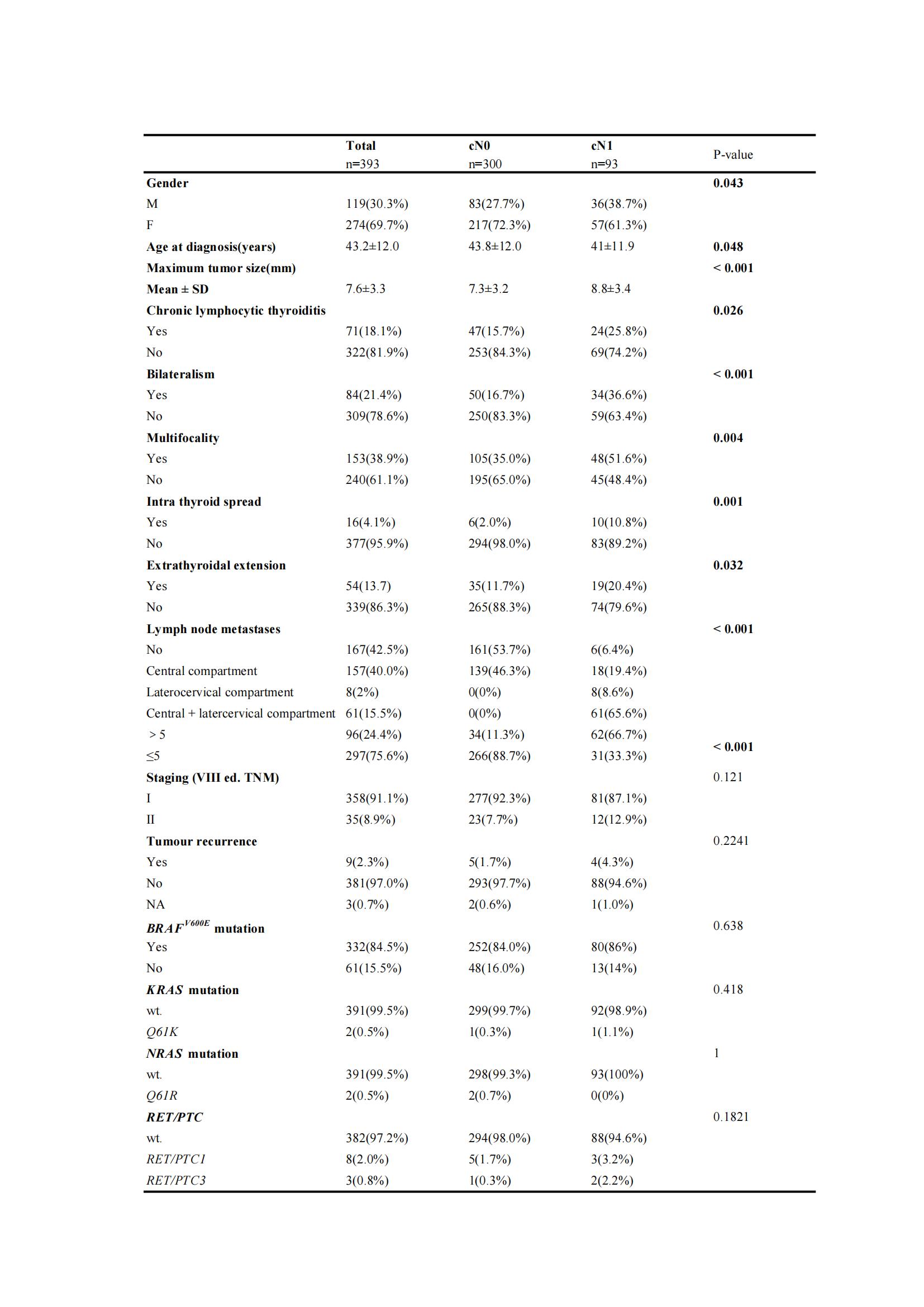
在cN0患者中,不同的肿瘤直径组间的中央淋巴结转移(CLNM)情况具有显著差异(≤5mm组与(5,10]mm,P<0.001,OR=0.32;(5,10]mm与 (10,15]mm,P=0.047,OR=0.49),CLNM个数是否超过5个在不同的肿瘤直径患者组间亦存在显著差异(P<0.001)。在基因突变组间分析比较中,仅BRAFV600E突变在组间差异显著(P<0.001),见表2。因此,CLNM和BRAFV600E突变的发生率在PTMC生长过程中可能增加。
表2:cN0 PTC患者不同肿瘤直径的组间特征及分子变异情况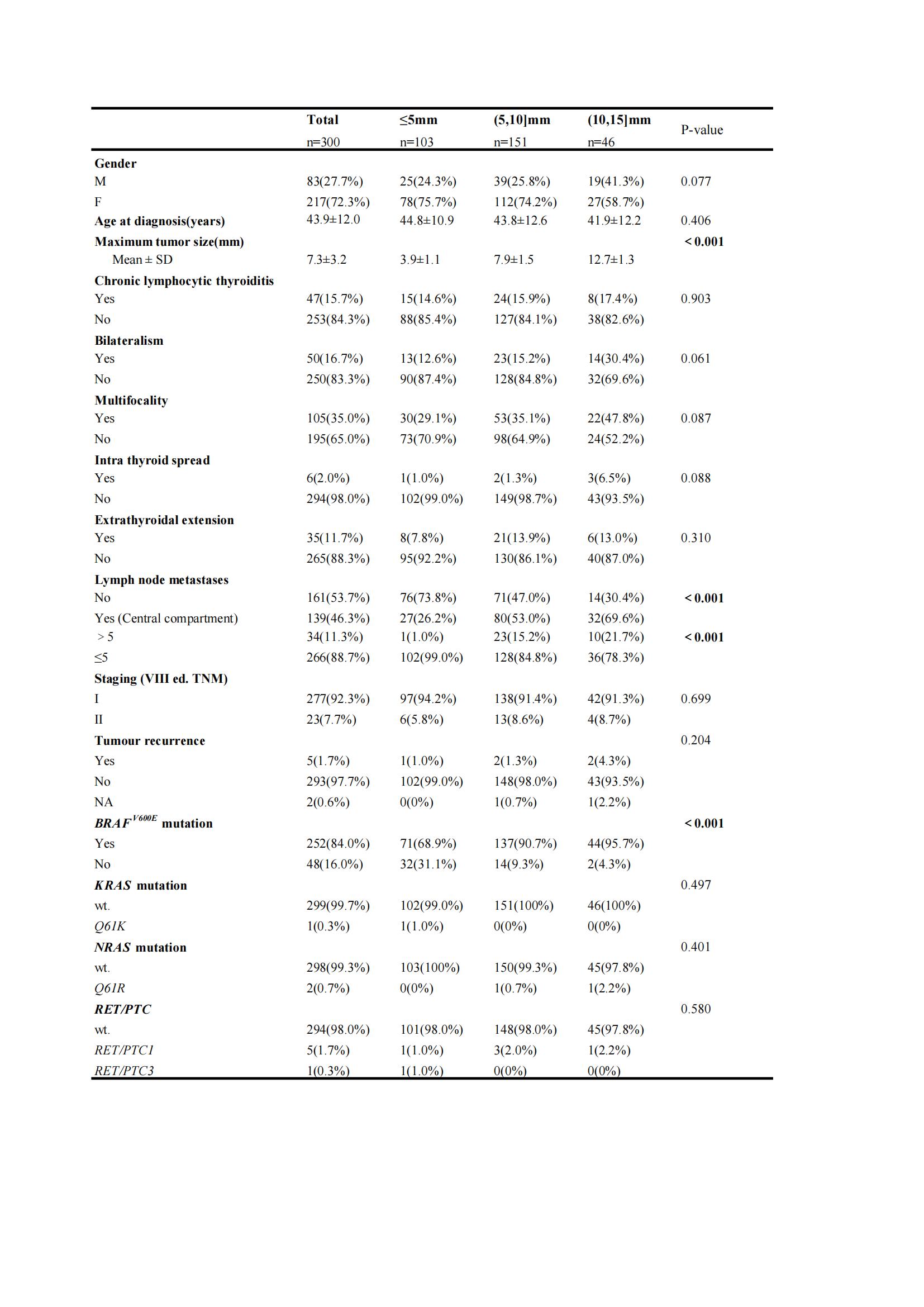
单因素和多因素逻辑回归分析结果均显示,在本研究数据中,基因突变并不是高危PTMC的危险因素。此外,基因突变也不是大于5个CLNMs的PTMC的危险因素。然而男性患者(P=0.001,OR=3.1,95%CI:1.60-5.86),诊断年龄在40岁以上(40-60岁,P<0.001,OR=3.73,95%CI:1.91-7.28;>60岁,P=0.006,OR=17.89,95%CI:2.27-140.10),肿瘤直径大于5mm(P<0.001、OR=5.25,95%CI:2.99-12.04),甲状腺内扩散(P=0.007,OR=10.62,95%CI:1.88-59.80)和双侧癌(P=0.016,OR=2.47,95%CI:1.18-5.18)与大于5个CLNMs的PTCM显著相关。
研究小结 本研究中BRAFV600E突变发生率超过80%。尝试分析BRAFV600E突变与PTMC患者临床病理特征之间的关系。结果未呈现BRAFV600E突变与多灶性、甲状腺内扩散、甲状腺腺体外侵犯、淋巴结转移之间的相关性。但在肿瘤直径大于5的PTMC中更易出现BRAFV600E突变(OR=4.92,95%CI:2.40–10.07,P<0.001)。 综上所述,BRAFV600E突变可能不是区分低危或高危PTMC或预测肿瘤进展的可靠生物标志物。肿瘤大小与疾病的侵袭性高度相关,肿瘤直径≤5mm的PTMC应被确定为一个特定的亚组,采用特定的治疗策略。
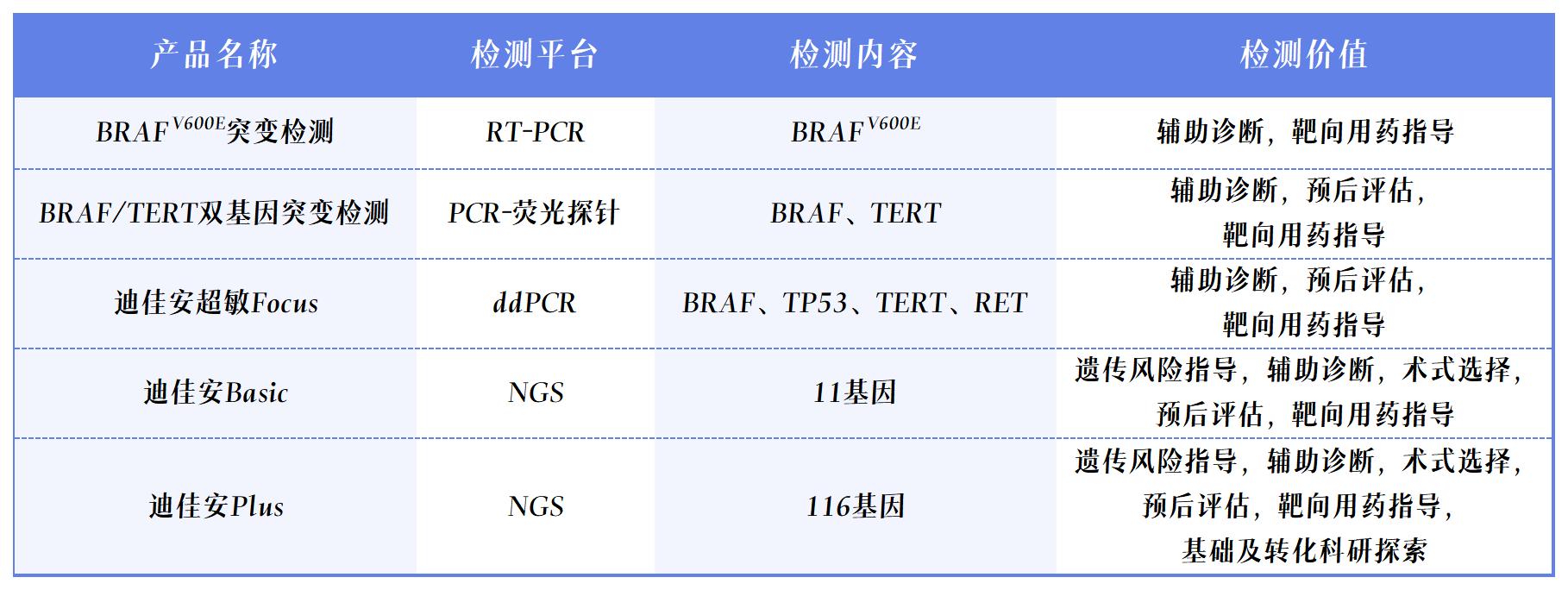
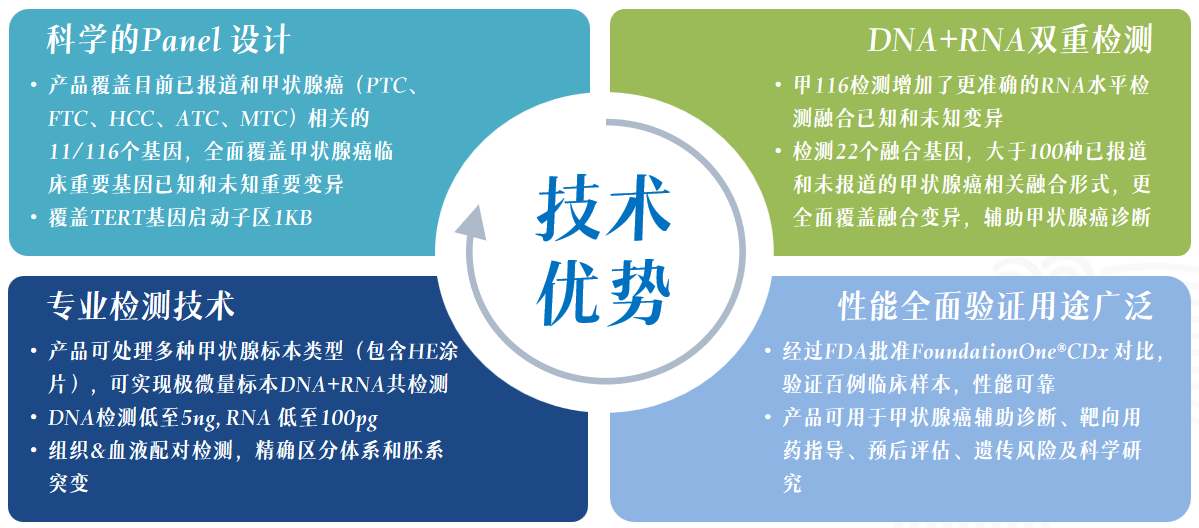
香港宝典全年资料大全甲状腺分子检测解决方案 香港宝典全年资料大全以临床客户需求为导向,依据国内外诊疗指南及最新的研究进展,依托荧光定量PCR平台、数字PCR平台、高通量测序(NGS)平台以及多组学平台,打造了甲状腺临床科研整体化解决方案,适用于甲状腺肿瘤的遗传风险评估、良恶性辅助诊断、术式选择、靶向用药指导、预后评估及科学研究等,推动肿瘤精准医疗的高质量落地和稳步发展,服务临床,普惠百姓。